Hallöchen,
ich habe mal wieder einen benoteten "Übungszettel" zu lösen und mal wieder ein paar Problemchen... Ich poste euch erstmal die Aufgaben und dann meine Lösungen/Idden:
Vorweg: Falls ihr nur wenig Zeit/Lust habt, dann legt bitte das Hauptaugenmerk auf 1c, 3(die Erklärung) und 4. Danke schön!
Aufgabe 1
1a. Ein Mol eines idealen Gases wird ausgehend von p1= 2bar und T1= 298,15 K reversibel und isotherm auf das Doppelte des Volumens expandiert. Berechnen Sie die Entropieänderung im System, in der Umgebung und insgesamt
1b. Ausgehend von den gleichen Anfangsbedingungen expandiert das Gas irreversibel und isotherm gegen den konstanten Außendruck p(außen)= 1bar. Berechnen Sie auch hier die Entropieänderung im System, in der Umgebung und insgesamt.
1c. Veranschaulichen Sie für beide Prozesse in einem pV-Diagramm die umgesetzte Entropie für die Umgebung und das System.
Aufgabe 2
Sie haben 1L Wasser in einem 500g schweren Aluminiumtopf auf 70°C erwärmt. Sie nehmen den Topf, der diesselbe Temperatur wie das Wasser haben soll, vom Herd und lassen ihn in einem 20°C warmen Raum abkühlen. Welche Entropieänderung ergibt sich für den Vorgang des Abkühlens auf Zimmertemperatur insgesamt? Handelt es sich bei der Abkühlung um einen spontanen Vorgang?
Anmerkung: Die spezifischen Wärmekapazitäten von Wasser und Aluminium betragen c
p(H
2O)=4,184 kJ/(kgK). Nehmen Sie näherungsweise an, dass die Wärmekapazitäten unabhängig von der Temperatur sind.
Aufgabe 3
Berechnen Sie d
rG°
298K für die folgenden Reaktionen. Geben sie an, ob die Reaktionen spontan in die angegebenen Richtungen ablaufen. (Was sagt Ihre eigene Erfahrung? Erläutern Sie scheinbare Widersprüche!)
a. H
2 (g) + 1/2 O
2 (g) --> H
2O (l)
b. C
6H
12O
6 (s) + O
2 (g) --> 6 H
2O (l) + 6 CO
2 (g)
Gegeben sind dann Werte für:
S° von H
2 (g), O
2 (g), H
2O (l), C
6H
12O
6 (s), CO
2 (g)
d
fH° von H
2O (l), CO
2 (g), C
6H
12O
6 (s)
Aufgabe 4
In einem Experiment bei T=0,001 K soll einer Probe eine Wärmeenergie von 1000 kJ mit einer idealen thermodynamischen Kältemaschine entzogen werden. Die obere Arbeitstemperatur der Maschine liegt bei 25°C. Wie hoch sind die elektrischen Energiekosten bei einem Preis von 10 Cent pro kWh? Welche Kosten entstehen bei einem entsprechenden Wärmeentzug bei T= 1K, 10K bzw. 273K? Was sagt dieses Experiment über die Erreichbarkeit des absoluten Nullpunktes aus?
Tipp: Eine ideale Kältemaschine ist eine Maschine, die einem kälteren Reservoir die Wärme Q
43 entzieht und dann unter Verrichtung von Arbeit W einem wärmeren Reservoir die Wärme Q
21 zuführt. Leiten Sie zunächst den Wirkungsgrad einer solchen umgekehrt laufenden Carnot-Wärmekraftmaschine her!
Meine Idden:
1a. Wenn ich die Formel dS(sys)=n*R*ln(V2/V1) verwende erhalte ich als Entropie des Systems 5,763 J/K. Da bei einem reversiblen Prozess die Summe von Entropie des System und der Umgebung immer Null ist, ist die Entropie der Umgebung -5,763 J/K.
1b. Wenn ich die selbe Formel wie bei a nehme und laut dem Boyle'schen Gesetz annehme, dass (V2/V1) = (p1/p2) erhalte ich dS(sys)=n*R*ln(p1/p2). Das ergibt als Entropie des Systems auch 5,763 J/K. Die Entropie des Umgebung ist bei irreversiblen Prozessen immer Null; die Gesamtentropie somit auch 5,763 J/K.
1c. Hier habe ich ein paar Probleme. Mir ist unverständlich, wie ich die umgesetzte Entropie in einem pV-Diagramm darstellen soll. Ich meine, in dem gehts doch nur um p und V und nicht um die Entropie?! Ist die umgesetzte Entropie denn dS oder wie? Bitte helft mir ich steh aufm Schlauch...
2.
Hier habe ich die Formel dS(sys)= c[SUB]p[/SUB] * m
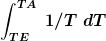
genommen und das dann einmal für Wasser und einmal für Aluminium ausgerechnet. Und für die Umgebung: dS(umg)= c[SUB]p[/SUB]
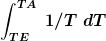
= 0
Somit ist die Gesamtentropie die Summer dieser 3 Werte = -729,5 J/K
Um zu entscheiden, ob die Abkühlung spontan verläuft:
dG = Vdp - Sdt
dG = 0 - (-729,5 J/K)*(-50K) = -36,475 kJ --> exergonisch, spontan!
3.
Das Berechnen habe ich glaub ich hinbekommen. Ich bin nur wegen dem scheinbaren Widerspruch irritiert. Ich habe für beide Reaktionen negative Werte heraus, was dafür spricht, dass sie spontan ablaufen. Meine Erfahrung sagt mir jedoch, dass dies nicht so ist. Aber wie ist die Begründung? Ist es vielleicht so, dass die Reaktionen erst spontan ablaufen, wenn die Aktivierungsenergie überwunden wurde? Oder wäre das dann schon wieder nicht mehr spontan?! Ich weiß es nicht...
 4.
4.
Bei dieser AUfgabe habe ich große Probleme. Ich habe die normale Wärmemaschine schon irgendwie nicht recht gecheckt und diese hier schon gar nicht... Habt ihr vielleicht nen Ansatz in Form irgendeiner Formel oder so?!
 Nun noch eine extra-Frage:
Nun noch eine extra-Frage: Ich bin Lehrämtler und mache grad PC1 und hab doch so meine Probleme... Leider finde ich außer dem Atkins kein Buch, dass die Sache mal von Grund auf (beginnend mit kleinstem Niveau) erklärt. Kennt ihr vielleicht eins oder ne gute Internetseite für PC oder so? Atkins ist zwar eigentlich echt gut, mir manchmal aber zu kompliziert...
Viele liebe Grüße, und vielen Dank für eure Mühen
Anja