Hallo, ich bin mir bei der folgenden Frage unsicher. Passt mein Lösungsansatz?
Sie haben sich inzwischen ein chemisches Grundwissen angeeignet und werden um
Rat gefragt. Wie würden Sie die folgende Frage beantworten?
„Warum können sich Atome des gleichen Elementes miteinander verbinden?“
Die Antwort sollte durch Zeichnung(en) ergänzt werden.
Atome streben einen energetisch stabilen Zustand an.
Dies wird durch eine vollbesetzte Außenschale erreicht. Bei den Hauptgruppenelementen ist der stabile Zustand fast immer eine Achterschale. Somit beruht die Atombindung auf der Bindung gemeinsamer Elektronenpaare.
Hierzu möchte ich das Beispiel Sauerstoff zeigen.
Sauerstoff enthält 6 Außenelektronen

Damit Sauerstoff nun also die Edelgaskonfiguration erreicht, fehlen 2 Außenelektronen. Dieses kann sich Sauerstoff durch ein weiteres Sauerstoffelement holen. Dafür teilen sich zwei Sauerstoffatome jeweils zwei Außenelektronen
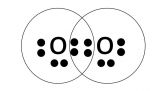
Es entsteht O2 durch eine Doppelbindung einer kovalenten Bindung.
Kurzgesagt verbinden sich Atome des gleichen Elements um die Edelgaskonfiguration zu erreichen.
Allerdings würde ich auch anmerken, dass sich nicht nur Atome des gleichen Elements miteinander verbinden können. Das kann man am Beispiel CO2 festmachen. Hier verbinden sich die Atome von Kohlenstoff C und und Sauerstoff O miteinander. Kohlenstoff besitzt 6 Außenelektronen. Kohlenstoff dagegen nur 4.
Kohlenstoff benötigt 4 weitere Außenelektronen und Sauerstoff 2 Außenelektronen.
Somit muss sich Kohlenstoff mit zwei Sauerstoffatomen verbinden um die Edelgaskonfiguration zu erhalten
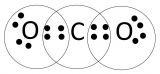
es entsteht CO2 also Kohlenstoffdioxid
Hallo, ich bin mir bei der folgenden Frage unsicher. Passt mein Lösungsansatz?
Sie haben sich inzwischen ein chemisches Grundwissen angeeignet und werden um
Rat gefragt. Wie würden Sie die folgende Frage beantworten?
„Warum können sich Atome des gleichen Elementes miteinander verbinden?“
Die Antwort sollte durch Zeichnung(en) ergänzt werden.
Atome streben einen energetisch stabilen Zustand an.
Dies wird durch eine vollbesetzte Außenschale erreicht. Bei den Hauptgruppenelementen ist der stabile Zustand fast immer eine Achterschale. Somit beruht die Atombindung auf der Bindung gemeinsamer Elektronenpaare.
Hierzu möchte ich das Beispiel Sauerstoff zeigen.
Sauerstoff enthält 6 Außenelektronen
[URL=https://www.directupload.net/file/d/6198/8q5xu49v_jpg.htm][IMG]https://s20.directupload.net/images/210529/temp/8q5xu49v.jpg[/IMG][/URL]
Damit Sauerstoff nun also die Edelgaskonfiguration erreicht, fehlen 2 Außenelektronen. Dieses kann sich Sauerstoff durch ein weiteres Sauerstoffelement holen. Dafür teilen sich zwei Sauerstoffatome jeweils zwei Außenelektronen
[URL=https://www.directupload.net/file/d/6198/troly2xd_jpg.htm][IMG]https://s20.directupload.net/images/210529/temp/troly2xd.jpg[/IMG][/URL]
Es entsteht O2 durch eine Doppelbindung einer kovalenten Bindung.
Kurzgesagt verbinden sich Atome des gleichen Elements um die Edelgaskonfiguration zu erreichen.
Allerdings würde ich auch anmerken, dass sich nicht nur Atome des gleichen Elements miteinander verbinden können. Das kann man am Beispiel CO2 festmachen. Hier verbinden sich die Atome von Kohlenstoff C und und Sauerstoff O miteinander. Kohlenstoff besitzt 6 Außenelektronen. Kohlenstoff dagegen nur 4.
Kohlenstoff benötigt 4 weitere Außenelektronen und Sauerstoff 2 Außenelektronen.
Somit muss sich Kohlenstoff mit zwei Sauerstoffatomen verbinden um die Edelgaskonfiguration zu erhalten
[URL=https://www.directupload.net/file/d/6198/ymt25h8x_jpg.htm][IMG]https://s20.directupload.net/images/210529/temp/ymt25h8x.jpg[/IMG][/URL]
es entsteht CO2 also Kohlenstoffdioxid