Habe auch nicht zitieren wollen, was mich verwirrte, sondern das, was die Lösung beinhaltet...Mane hat geschrieben:Hä? Wo steht denn da jetzt, dass SO3 nicht so gut löslich ist?
Nicht, dass die Professorin sich das selbst aus den Fingern gesogen hätte, aber copy-paste machts möglich... Habe (hoffentlich) das Original gefunden. Die entsprechende Passage gebe ich hier wieder:
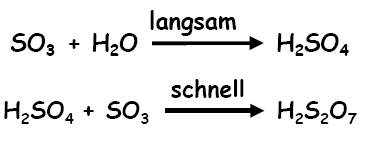
Und SO3 ist eine starke Lewis-Säure, wenn man der genannten Quelle glauben darf...
Grüsse
alpha


