Ich hoffe ihr wisst in etwa wie die aussehen :D
Bsp. Sn1
Also anfangs liegen ja die Edukte vor (energiediagramm waagerecht auf mittelhoher Energiestufe.
Bildung ÜZ1
Energie steigt an. (weil Energie zur Spaltung der Stoffe benötigt wird oder?)
Dann das Zwischenprodukt. (carbenium Ion)
Energiestufe sinkt minimal
Warum?
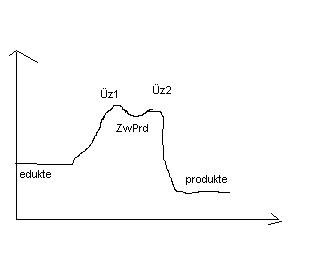
Als nächstes der ÜZ2, energiestufe steigt minimal, ca. auf das level von ÜZ1.
Dann fällt die Energiestufe rapide, sogar tiefer als die von den Edukten.
Die Produkte liegen jetzt vor.
Warum haben die eine geringere Energiestufe als die Edukte?
Noch andere Fragen:
Wir geben 2 Stoffe zusammen und eine Reaktion findet statt.
Dabei wird ein Tempanstieg gemessen.
Was kann man aus dieser Information (Tempanstieg) interpretieren?
Exotherm oder Endotherm?
Andere Frage:
Es gibt ja wohl endotherme Reaktion die von selber ablaufen (ist das nicht widersprüchlich?)
Als Bsp. die Verdunstung von Wasser wenn man ausm Badesee steigt. Kann mir das jmd erklären?


