Seite 2 von 2
Verfasst: 12.02. 2006 19:59
von alpha
Mane hat geschrieben:Hä? Wo steht denn da jetzt, dass SO3 nicht so gut löslich ist?
Habe auch nicht zitieren wollen, was mich verwirrte, sondern das, was die Lösung beinhaltet...
Nicht, dass die Professorin sich das selbst aus den Fingern gesogen hätte, aber copy-paste machts möglich... Habe (hoffentlich) das
Original gefunden. Die entsprechende Passage gebe ich hier wieder:
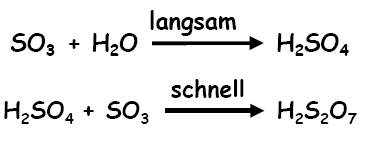
Und SO3 ist eine starke Lewis-Säure, wenn man der genannten Quelle glauben darf...
Grüsse
alpha
Verfasst: 12.02. 2006 20:40
von Cabrinha
beide Aussagen sind in der Tat ähnlich.... SO3 reagiert nach beiden Quellen ziemlich heftig mit Wasser...
Verfasst: 12.02. 2006 20:43
von alpha
Ja, aber nach dem, was im Bild steht, hätte es langsam geschen sollen, deshalb war ich ja verwirrt und deshalb habe ich ja die ganze Diskussion vom Zaun gerissen, weil ich mir nicht erklären konnte, weshalb SO3 langsam mit H2O reagieren sollte - was es offensichtlich auch nich tut und also gibt es meine Frage eigentlich auch nicht (mehr)...

Verfasst: 13.02. 2006 07:35
von Manes_Schatz
In der Tat ist SO3 eine starke Lewis-Säure!
Zumindest kann man damit ohne Katalysator Benzol sulfonieren...und soweit ich weiß, braucht man für eine SE-Reaktion am Aromaten entweder einen recht elektronenreichen Aromaten oder ein starkes Elektrophil...