Seite 1 von 1
Magnetochemie
Verfasst: 22.01. 2005 02:57
von merlin
Hallo Chemiker.
Ich habe hier eine etwas sonderbare Aufgabe zu bearbeiten:
Cerdioxid (Oxidationsstufe 4??)ist diamagnetisch (Ionen mitabgeschlossenen Unterschalen sind also diamagnetisch???und Ionen mit Edelgaskonfiguration auch??

), Cerdisulfid (Oxidationsstufe+3???) dagegen paramagnetisch mit einem magnetischen Moment von 2.6BM(Term 2F5/2, Greenwood E.). Erklären Sie diese Beobachtung.
Wenn man nicht mal weiß, welche Bindungsverhältnisse dabei vorliegen, ist das schwer zu beantworten.

Wenn jemand von euch eine leise Ahnung hat, oder Literatur dazu kennt freue ich mich auf Antwort.

Gruß Merlin
PS: im HOWI und im Greenwood Earnshaw war darüber nichts zu finden, das einzige, was ich herausgefunden habe, ist die ElektronenKonfiguration: 4f1 5d2 6s2 und die bevorzugten Oxidationszahlen 3 und 4 nebst Termsymbol 2F5/2

Verfasst: 22.01. 2005 12:01
von AV
Na ja eigentlich hast Du dieErklärung schon gegeben:
Die Elektronenkonfiguration im Cer ist: [Xe] 4f2 6s2
In der Oxidationsstufe +4 verliert Cer also seine gesamte Valenzschale und es bleibt eine voll besetzte Unterschale zurück, die Xenonkonfiguration.
In +3 bleibt dem Cer zusätzlich noch ein 6s-Elektron.
Dieses einzelne Elektron ist ungepaart. Durch seine Bewegung (Bahndrehimpuls und Spin) erzeugt es als geladenes Teilchen ein magnetisches Moment. In der Folge ist die Substanz Paramagnetisch.
In der Oxidationsstufe +4, also volle Edelgasschale, sind alle Elektronen gepaart. Das heißt aber auch, dass sich die Momente, die durch die Elektronen erzeugt werden gegenseitig aufheben. Der Paramagnetismus geht flöten, und es verbleibt nur noch der Diamagnetismus.
Magnetochemie
Verfasst: 22.01. 2005 18:02
von merlin
Danke AV
Die Elektronenkonfiguration habe ich nun: Ce(0): [Xe]4f1 5d1 6s2
Wie aber sieht die Struktur von Ce(III)S2 im Gegensatz zu Ce(IV)O2 aus?
Könnte ne Defektstruktur sein!????
merlin
Verfasst: 22.01. 2005 22:34
von AV
Das sind schon beides kristaline Substanzen und keine Defektstrukturen. Die Koordinationszahl ist halt anders.
Ich komm jetzt auf Anhieb zwar nicht an die Daten ran, aber ich vermute mal, bim Ceroxi eine KZ von 4 und damit eine Tetraedrische Umgebung der Cer-Atome von Sauerstoff, ich denke jetzt mal, das wird ähnlich aussehen, wie beim SiO2, ist aber nur ne Vermutung.
Beim Cersulfid, also Ce2S3 ist die KZ von Ce glaub ich 8, wobei die Schwefel in trigonalen Dodekaedern um Ce angeordnet sind ...
Aber sicher bin ich mir da nicht.
Ach ja:
Die Elektronenkonfiguration:
Ce(0): [Xe]4f2 6s2
Ce(I): [Xe]5d1 6s2
Ce(II): [Xe]6s2
Ce(III):[Xe]6s1
Ce(IV): [Xe]
Magnetochemie
Verfasst: 23.01. 2005 14:10
von merlin
Hallo
und wie sieht Ce(III)S2 also das paramagnetische Disulfid aus?

Verfasst: 23.01. 2005 15:41
von AV
Sorry, aber von CeS2 hab ich noch nie gehört ... hört sich für mich auch nicht nach einer stabilen Verbindung an, wenn das Ce dann auch noch dreiwertig sein soll ...
Das Dioxid hat übrigens anscheinend Calciumfluorit-Struktur (Also Cer kubisch flächenzentriert und Sauerstoff auf allen Tetraederlücken)
Magnetochemie
Verfasst: 24.01. 2005 00:54
von merlin
Ave AV :lol:
Das ist eben das, was mich stutzig macht:
Paramagnetisches CeS2 mit einem magnetischen Moment von 2,6BM(Elementaranalyse stimmt [EDX] und magnetische Messung auch [Gouy-Methode]).
Eine Recheche im Greenwood/Earnshaw, Chemie der Elemente, 1988,1,1593 lässt das Termsymbol 2F5/2 erahnen, also Ce(III). Dies bedeutet aber, dass Schwefel im Durchschnitt eine Ladung von -1,5e tragen müßte. Dies wäre aber nur mit folgender Ladungsverteilung möglich: 3mal S(-II) und 1mal S(0) auf 2mal Ce(III). Daher die Vermutung mit der Kristall-Defektstruktur (und die Frage danach).
Ich weiss es aber leider nicht genau, und finde nichts dazu.
Wenn dir, oder jemandem anders Literatur zu diesem Thema einfällt, möge er/sie es mir mitteilen.
Der Fall CeO2 ist nun völlig klar, danke nochmal für die Diskussion.
merlin
Verfasst: 25.01. 2005 17:27
von AV
Also ich hab jetzt noch mal den Pearson bemächtigt und explizit nach CeS2 geschaut...
Das Zeug existiert wirklich, und wenn ich mir das so anscheue, dann ist es wirklich Ce(III). Und es ist keine Defeltstruktur, sondern wunderschön kristallin...
Ich hab Dir mal ein Bild von der Struktur gemacht:

Es sind übrigens alle Schwefel und alle Cer mit Bindungen versehen, die, die keine oder zu wenige haben, haben diese Bindungen zu Atomen in der nächsten Elementarzelle ...
Für Ce
2S
3 hab ich ein Bild von den Bindungsverhältnissen gefunden. ist zwar für das Lanthansulfid, aber die sind in der Hinsicht gleich (Ce entspricht La):

Und Cerdioxid gibt's zum Schluß auch nochmal ...:

Verfasst: 25.01. 2005 18:07
von HoWi
Also bei mir schaut die Struktur etwas anders aus. Sie wurde schon 1979 gelöst, aber 1983 nochmal "überarbeitet".
In der Datenbank steht folgendes: Cerium(IV) sulfide - prepared at 1773K and 5.5GPa!
Also keine "Standardsynthese"

Struktur folgt! Sieht aber anders aus als die von AV gepostete!
Ciao
HoWi
Verfasst: 25.01. 2005 20:05
von Gast
Vielen Dank AV! :D
vor allem für die Strukturen!!!
Hab übrigens Literatur dazu gefunden, allerdings französisch und auf Mikrofilm :cry:
(Ce(III)S2)x wird auch als polymere Struktur angegeben: jedes Cer hat dort 3 Bindungen zu Schwefel.
merlin
Verfasst: 26.01. 2005 00:25
von AV
na ja ... siehe oben ...
@HOWI:
Hab die Daten direkt aus'm Pearson ... da gab's aber halt noch ne andere Aufstellung (auch mit ner anderen Raumgruppe), die aber im Prinzip das selbe war....
Verfasst: 26.01. 2005 12:35
von HoWi
So hier endlich die versprochene Struktur aus der Kristalldatenbank! (ICSD-Datenbank)
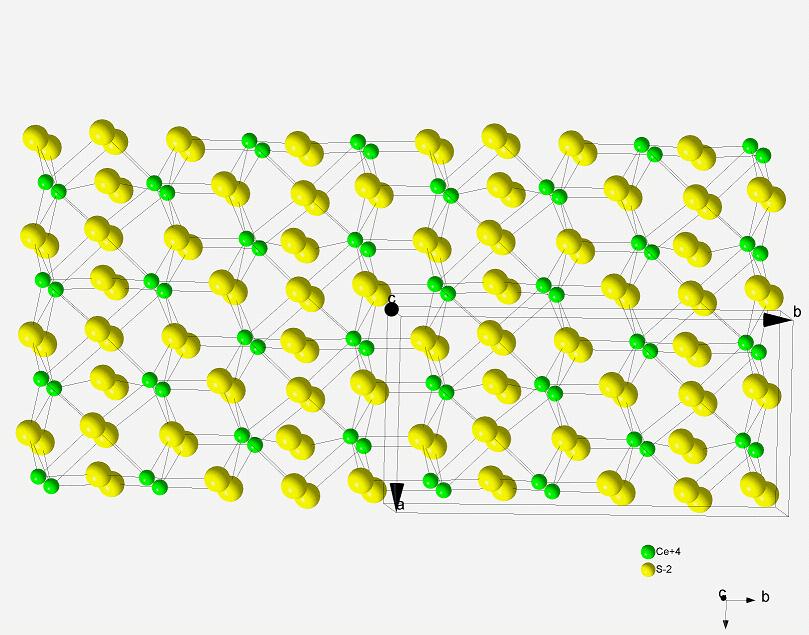
HoWi
Verfasst: 27.01. 2005 00:55
von AV
Na ja ... wie gesagt ... da gibt's wohl mehrere Modifikationen von ... die Hochdruckteile hab ich mir natürlich nicht angeschaut ... Das Teil bei Normalbedingungen sieht (zumindest laut Pearson) so aus, wie oben gezeigt ... wenn ich mich beim abtippen nicht arg verhauen habe ... aber meistens klappt das schon ...

 ), Cerdisulfid (Oxidationsstufe+3???) dagegen paramagnetisch mit einem magnetischen Moment von 2.6BM(Term 2F5/2, Greenwood E.). Erklären Sie diese Beobachtung.
), Cerdisulfid (Oxidationsstufe+3???) dagegen paramagnetisch mit einem magnetischen Moment von 2.6BM(Term 2F5/2, Greenwood E.). Erklären Sie diese Beobachtung.





