Seite 1 von 1
Anorganische Chemie/Koordinationschemie
Verfasst: 24.03. 2023 12:46
von Chemiker129
Ich frage mich, ob CF und CF3 (bzw. CCF3) als neutrale Liganden anzusehen sind. Handelt es sich bei dem Fe in der Verbindung Fe3(CO)8(CF)3CCF3 um Eisen in der Ox. Stufe 0?
Re: Anorganische Chemie/Koordinationschemie
Verfasst: 24.03. 2023 13:05
von Chemik-Al
Der Trifluormethyl-Ligand ist kein neutraler Ligand,die aus der "Summenformel" sich ergebenden möglichen Liganden sind mir so nicht bekannt,es scheint sich auch nicht um Carbene zu handeln.
Hättest du mehr Infos zu dem Komplex(Literaturverweis etc.)?
Chemik-Al.
Re: Anorganische Chemie/Koordinationschemie
Verfasst: 24.03. 2023 15:21
von Chemiker129
In der Struktur findet man CCF3 an dessen Kohlenstoffatom rechts und links Kohlenstoffatome mit einem Fluor Atom gebunden sind. Zusätzlich ist dann noch eine CF Gruppe an einem Fe lokalisiert. Ich hoffe ich habe mich jetzt nicht vertippt
Re: Anorganische Chemie/Koordinationschemie
Verfasst: 24.03. 2023 16:30
von Chemik-Al
Bitte Literaturverweis oder Bild der Struktur hier hochladen.So kann ich nicht erkennen,was da wirklich genau vorliegt.
Würde man dies (CF)3CCF3 als einzelnen Liganden betrachten,hätte man mindestens bei den beiden "CF"-Einheiten noch freie Valenzen.
Es gibt zwar auch Carbin-Komplexe,wo u.U. auch eine Metall-Carbindreifachbindung zu einem CF vorliegt,aber hier wären nach deiner Beschreibung eine CF-Gruppe direkt zum Eisen koordiniert(nur als Carbin möglich),dazu eine 1,1,1-Trifluormethylgruppe,wo am C2 zwei weitere CF-Gruppen hängen sollen.
Bekannt ist dagegen,daß der Perfluorisoprpyl-Ligand umgewandelt werden kann in den Bis-Trifluormetykcarben-Liganden,also ein C,doppelt gebunden an ein Metallzentrum,mit zwei CF3-Gruppen am Carben-C.
Bevor ich hier noch weiter widl spekuliere,bitte mehr Infos.
Woher stammt die Summenformel,welche Literatur... ?
Chemik-Al.
Re: Anorganische Chemie/Koordinationschemie
Verfasst: 24.03. 2023 16:53
von Nobby
Könntest Du ein Link mit Bild angeben.
In Eisencarbonylen ist CO 0 aber andere Liganden können positive oder negative Ladungen auf das Eisen induzieren.
Ich habe jetzt nur dieses gefunden. Ist aber nicht flouriert.

Re: Anorganische Chemie/Koordinationschemie
Verfasst: 24.03. 2023 17:20
von Chemik-Al
Du hast da zwei Eisencarbonylkomplexe mit dem Trimethylenmethan-Liganden,welche u.a. durch Methylenierung von Allenen gebildet werden(Eisen-Carben-Komplex als Methylenierungsreagenz).
Aber auch die fluorierte Version entspräche nicht dem Liganden des TES.
Carbene können formal als "neutrale" Liganden betrachtet werden,in der Regel 2VE.Einfache AlkylLiganden(auch verzweigte,perfluorierte) dagegen sind anionische Liganden.Da die Struktur hier nicht klar ist,kann man auch nichts zur formalen Oxidationsstufe der Fe sagen.
Daher kann hier eigentlich nur der TES mit mehr Inofs helfen.
Chemik-Al.
Re: Anorganische Chemie/Koordinationschemie
Verfasst: 24.03. 2023 18:34
von Chemiker129
Habe eine Kristallstruktur der Verbindung und würde gerne das Bild hochladen, scheint aber nicht zu funktionieren. Gibt es da andere Möglichkeiten?
Re: Anorganische Chemie/Koordinationschemie
Verfasst: 24.03. 2023 19:03
von Chemik-Al
Zum Thema "Bilder hochladen" wird dir Nobby sicherlich helfen können.
Noch mal zur Struktur:Woher hast du die,was ist dein Hintergrund zu der Frage,gibt es eine Literaturstelle????
Chemik-Al.
Re: Anorganische Chemie/Koordinationschemie
Verfasst: 24.03. 2023 19:22
von Nobby
Für Bilder.,
die auf einen Hoster wie bildhost.com, imgbb, postimages.com,u.a. hochladen und dann die Grafikadresse in die Funktion img/ img ( kleines Bergicon) einfügen.
Direkte Einführung von Bildern, ist wegen der begrenzten Größe des Servers leider nicht möglich.
Re: Anorganische Chemie/Koordinationschemie
Verfasst: 24.03. 2023 22:00
von Chemiker129
https://bildhost.com/image/abV9LW
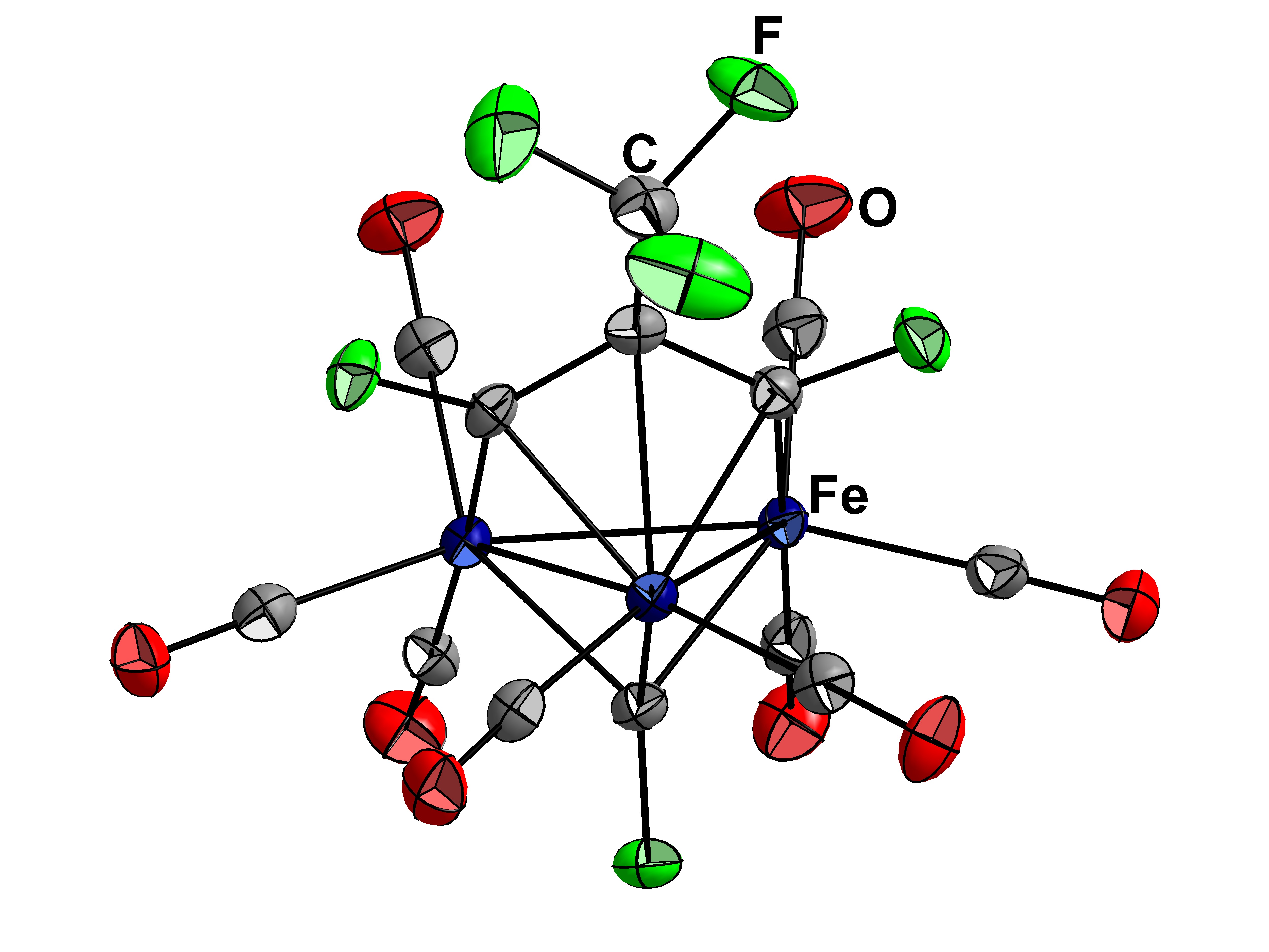
Wir haben einen Kurs zur Einkristallröntgendiffraktometrie, da bekommen wir Kristalldaten und lösen, verfeinern diese. Soweit ich weiß ist diese Verbindung nicht bekannt in der Literatur, nur ähnliche Verbindungen (siehe:
https://pubs.acs.org/doi/pdf/10.1021/cr00055a001). Mein Hintergrund der Frage ist einfach, dass diese Liganden bisher nicht zu den gängigen die man in Vorlesungen gelehrt bekommt zählen und ich möchte gerne wissen, inwieweit man somit auch weitere Analytische Methoden an dieser Verbindung diskutieren kann.
Re: Anorganische Chemie/Koordinationschemie
Verfasst: 25.03. 2023 11:49
von Chemik-Al
Danke für´s Bild und den Hintergrund!
So kann man erkennen,daß in dem Komplex einmal ein dreifach verbrückender Carbin-Ligand vorliegt(µ3-CF),der an die drei Eisen koordiniert.
Zum anderen ein dreizähniger Ligand,mit zwei zweifach verbrückenden Carben-Enden(µ2-CF-R) und ein zentralen einfachkkoordinierendes C.
Der Ligand ist mir so bisher nicht bekannt,ist schon recht ungewöhnlich.
Es gibt in dem Komplex sicherlich Ansätze für weitere analytische Aspekte,u.a. elektronische Verhältnisse bedingt durch die CF-Koordnationen.
Vorerst nur die,muß mal schauen.
Chemik-Al.
Re: Anorganische Chemie/Koordinationschemie
Verfasst: 25.03. 2023 13:00
von Chemiker129
Danke für die Antwort. Die Carbine und Carbene musste ich mir echt wieder ins Gedächtnis rufen, aber Danke dafür! Aber können wir µ2-CF-R von einem Carben-Ende sprechen? Ich bin nicht so familiär mit Carben Chemie, würde man nicht eine Doppelbindung erwarten?
Und liege ich richtig damit, dass wir hier Fe(+II) an allen drei Metallzentren haben?
Re: Anorganische Chemie/Koordinationschemie
Verfasst: 25.03. 2023 15:54
von Chemik-Al
Wenn du dir die verbrückenden Carben-,Carbinkomplexe anschaust,hat man ben nicht mehr die Mehrfachbindung wzischen C und einem Metallzentrum,sondern mehrere Einfachbindungen zu zwei oder drei Metallzentren.
Bei der formalen Oxidationsstufen müßte ich nochmal genauer überlegen,da ist es nicht ganz so einfach zu entscheiden,welche Ladungen die Liganden tragen,besonders,wenn es sich um einen so ungewöhnlichen Liganden wie hier handelt.
Chemik-Al.
Re: Anorganische Chemie/Koordinationschemie
Verfasst: 25.03. 2023 19:58
von Chemiker129
Ah, Danke.
Oder gar Fe(0). Aufgrund des unbekannten Liganden muss ich sagen, ist das gar nicht so leicht und die Literatur ist leider auch nicht gerade ergiebig...

