Seite 1 von 1
Löslichkeitsprodukt - Berechnung
Verfasst: 17.03. 2002 16:49
von Katrin

Hallo liebe Chemiker

ich hoffe, Ihr könnt mir helfen und erklärt mir, wie ich folgende Aufgabe der Reihe nach rechnen muss (ausführlich wäre nicht schlecht):
In einem Liter einer 0,02 m Salzsäure sind 0,01 mol Co 2+ gelöst. Es ist zu berechnen, ob Cobaltsulfid ausfällt, wenn die Lösung mit H2S gesättigt wird. Volumenänderungen können unberücksichtigt bleiben.
Löslichkeitsprodukt von CoS: 6*10-21 Konzentration H2S: 0,1 mol/l
K1 bzw. K2 für H2S: 10-7 bzw. 10-13
DANKE!!!
Re: Löslichkeitsprodukt - Berechnung
Verfasst: 18.03. 2002 12:07
von ondrej
kleiner Hinweis:
K1 bezieht sich auf die Reaktion H
2S --> H
+ + HS
-
K2 dann auf HS
- --> H
+ + S
2-
Du musst noch berücksichtigen, dann [H
+] durch die Salzsäure erhöht wird und zwar um 0.02 mol l
-1
Sollte dann [Co
2+]. [S
2-] das Löslichkeitsprodukt übersteigen fällt CoS aus.
![cool B-]](./images/smilies/icon_cool.gif)
Ondrej
[%sig%]
auch zu Löslichkeitsprodukt
Verfasst: 08.01. 2004 19:17
von KJay
Moin!
Ich komme hier nicht weiter:
geg.: PbSO4 ist zu 0,038 g/l in H2O löslich
ges.: Löslichkeitsprodukt
Die Formel fürs Löslichkeitsprodukt hab ich ja, aber wie, verdammt nochmal, komme ich auch die Konzentrationen von Pb 2+ und SO4 2- ???

Vielen Dank!
Re: auch zu Löslichkeitsprodukt
Verfasst: 08.01. 2004 21:56
von ondrej
KJay hat geschrieben:Moin!
Ich komme hier nicht weiter:
geg.: PbSO4 ist zu 0,038 g/l in H2O löslich
ges.: Löslichkeitsprodukt
Die Formel fürs Löslichkeitsprodukt hab ich ja, aber wie, verdammt nochmal, komme ich auch die Konzentrationen von Pb 2+ und SO4 2- ???

Vielen Dank!
die ist durch 0,038 g/L gegeben
Verfasst: 08.01. 2004 22:06
von KJay
Na ja, das dachte ich mir fast, aber von da komme ich nicht weiter...
KL(PbSO4) = c(Pb+)*c(SO4-) (<--auf diese Konzentrationen komme ich nicht...)
PbSO4: 303 mol => 1g
11,5 mol => 0,038g
=> c(PbSO4)= 11,5 mol/l
Wie kann ich denn nun auf c(Pb+) und c(SO4-) kommen?
Danke

Verfasst: 09.01. 2004 14:45
von ondrej
KJay hat geschrieben:Na ja, das dachte ich mir fast, aber von da komme ich nicht weiter...
KL(PbSO4) = c(Pb+)*c(SO4-) (<--auf diese Konzentrationen komme ich nicht...)
PbSO4: 303 mol => 1g
11,5 mol => 0,038g
=> c(PbSO4)= 11,5 mol/l
Wie kann ich denn nun auf c(Pb+) und c(SO4-) kommen?
Danke

man nimmt an c(Pb+)=c(SO4-)=c(PbSO4)
denke ich zumindest ....
Verfasst: 11.01. 2004 18:47
von KJay
Das würde in meinem Fall ja heißen:
c(Pb 2+) = c(CO4 2-) = c(PbSO4) = 11,5 mol/l
also
KL (PbSO4) = c(Pb 2+) * c(SO4 2-) = 11,5^2 = 132,25
aber die Lösung ist KL(PbSO4) = 1,6 * 10^( -8 )
Hab keine Ahnung, wie ich darauf kommen soll...

Trotzdem danke

Verfasst: 12.01. 2004 11:10
von ondrej
Das hängt damit zusammen, dass Du falsch rechnest:
Du hast eine Löslichkeit von 0,038 g/L
Die Molmasse von PbSO
4 beträgt 303,26 g/mol
um nun die Konzentration auszurechnen, musst Du 0,038 durch 303,26 dividieren:
0,038 (g/L) / 303,26 (g/mol) = 1,25E-4 mol/L
Und diese 1,25E-4 entsprechen Deinem c(Pb
2+) = c(SO
42-)
Als Ergebnis erhält man dann 1,57E-8 mol
2/L
2
Kleiner Tip: überprüfe immer die Einheiten, dann findet man meistens den Fehler schneller.

Ondrej
Verfasst: 19.01. 2004 13:28
von KJay
Danke!
Verfasst: 22.11. 2006 21:13
von Gast
ondrej hat geschrieben:KJay hat geschrieben:Na ja, das dachte ich mir fast, aber von da komme ich nicht weiter...
KL(PbSO4) = c(Pb+)*c(SO4-) (<--auf diese Konzentrationen komme ich nicht...)
PbSO4: 303 mol => 1g
11,5 mol => 0,038g
=> c(PbSO4)= 11,5 mol/l
Wie kann ich denn nun auf c(Pb+) und c(SO4-) kommen?
Danke

man nimmt an c(Pb+)=c(SO4-)=c(PbSO4)
denke ich zumindest ....
Verfasst: 22.11. 2006 21:47
von ethoxyethan
KSp=L^2
(0,125mmol/L)^2 = 1,57 * 10^-8 mol^2/L^2
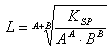
A=1; B=1