galvanische Zelle
Verfasst: 04.10. 2006 15:31
Hallo Leute!
Ich habe eine Aufgabe und die dazugehörige Lösung...allerdings würde ich selbständig niemals auf diesen Lösungsansatz kommen und kann ihn, obwohl erklärt auch nicht nachvollziehen!
Aufgabe:
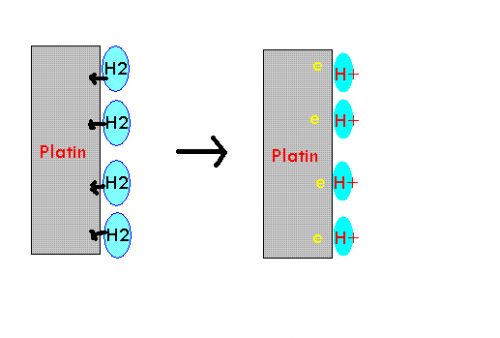
Eine galvanische Zelle besteht aus einer Wasserstoff-Halbzelle und einer unbekannten Halbzelle, beider unter Standard-Bedingungen.
Beim Verdünnen der Lösung in der unbekannten Halbzelle wird die Spannung der galvanischen Zelle größer.
Welche der folgenden Aussagen können richtig sein?
I) es handelt sich um eine Zn2+/Zn Halbzelle
II) es handelt sich um eine Cu2+/Cu Halbzelle
III) es handelt sich um eine Cl2/Cl- Halbzelle
Lösung:
hier wird nun mit der Nerntschen-Gleichung argumentiert.
Es heißt dann, dass z.B. Kupfer als Akzeptorhalbzelle fungiert, und ihr Potential bei Verdünnung kleiner wird, die Spannung damit sinkt....
aber warum wird das Potential denn kleiner?
ich dachte ja erst, es würde was damit zu tun haben, dass es sich um eine Akzeptorhalbzelle handelt...
ABER: die Chlorhalbzelle ist ebenfalls eine Akzeptorhalbzelle...ihr Potential wird beim Verdünnen aber größer!
Es wäre wirklich sehr nett, wenn mir jemand diesen Sachverhalt (Spannung wird durch Verdünnen größer/kleiner) idiotensicher erklären könnte!
Víelen vielen Dank schoma;-)
Ich habe eine Aufgabe und die dazugehörige Lösung...allerdings würde ich selbständig niemals auf diesen Lösungsansatz kommen und kann ihn, obwohl erklärt auch nicht nachvollziehen!
Aufgabe:
Eine galvanische Zelle besteht aus einer Wasserstoff-Halbzelle und einer unbekannten Halbzelle, beider unter Standard-Bedingungen.
Beim Verdünnen der Lösung in der unbekannten Halbzelle wird die Spannung der galvanischen Zelle größer.
Welche der folgenden Aussagen können richtig sein?
I) es handelt sich um eine Zn2+/Zn Halbzelle
II) es handelt sich um eine Cu2+/Cu Halbzelle
III) es handelt sich um eine Cl2/Cl- Halbzelle
Lösung:
hier wird nun mit der Nerntschen-Gleichung argumentiert.
Es heißt dann, dass z.B. Kupfer als Akzeptorhalbzelle fungiert, und ihr Potential bei Verdünnung kleiner wird, die Spannung damit sinkt....
aber warum wird das Potential denn kleiner?
ich dachte ja erst, es würde was damit zu tun haben, dass es sich um eine Akzeptorhalbzelle handelt...
ABER: die Chlorhalbzelle ist ebenfalls eine Akzeptorhalbzelle...ihr Potential wird beim Verdünnen aber größer!
Es wäre wirklich sehr nett, wenn mir jemand diesen Sachverhalt (Spannung wird durch Verdünnen größer/kleiner) idiotensicher erklären könnte!
Víelen vielen Dank schoma;-)