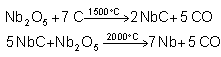Seite 1 von 3
So ne Erzaufgabe
Verfasst: 23.11. 2006 16:55
von Gast
Hi Leute
Ich hätte mal nen paar Fragen zur folgenden Aufgabe:
...Bislang enthalten viele Hochleistungskondensatoren das seltene Element Tantal, das in natürlichen Erzen in Gesellschaft mit dem häufigeren Element Niob vorkommt. Beide Metalle können aus den Metall(V)oxiden mit Kohlenstoff reduziert werden. Stelle die Reaktionsgleichungen auf. ...
Jetzt wollte ich fragen ob die beiden Metalloxide zusammen sind, wenn der Kohlenstoff dazugetan wird oder ob die schon getrennt sind.
Weiterhin wollte ich fragen wie ich rausbekomme ob nun CO2 oder CO entsteht.
Danke für die Antworten.
Verfasst: 23.11. 2006 17:01
von ethoxyethan
Verfasst: 23.11. 2006 17:06
von Gast
Und wieso entsteht da nicht CO2, sondern CO?
Verfasst: 24.11. 2006 00:11
von Manes_Schatz
Weil es da das wunderschöne Bouduard-Gleichgewicht gibt:
C + CO2 <-> 2 CO
Diese Reaktion ist stark endotherm (ΔH = +172KJ/mol) und damit liegt bei hohen Temperaturen das Gleichgewicht fast vollständig auf der rechten Seite.
Falls bei dieser Reaktion CO2 entstehen sollte, wird dieses praktisch sofort mit überschüssigem Kohlenstoff zu Kohlenmonoxid reagieren...
Verfasst: 24.11. 2006 00:15
von Manes_Schatz
Trennen kann man beide Elemente entweder über fraktionierte Destillation von NbF5 / TaF5 oder über die fraktionierte Kristallisation von K2[NbOF5] / K2[TaF7]. Das erstere ist in Wasser leicht, das zweite schwer löslich.
Verfasst: 24.11. 2006 13:52
von alpha
@ Manes_Schatz: Die Reaktionsbedingungen waren auch nicht gegeben und ob die auch noch erwartet werden, weiss ich nicht...
Vielleicht ist es besser zu sagen, dass CO bei solchen Prozessen immer (stimmt das?) primär entsteht, dass es also nicht falsch sein sollte, bei Metallreduktionen immer CO entstehen zu lassen... - Denke allerdings, dass auch niemandem ein Strick aus einer solchen Frage gedreht wird, es sei denn, es geht gerade ums Bouduard-Gleichgewicht

Es grüsst
alpha
Verfasst: 24.11. 2006 15:54
von Gast
Hey danke Leute
Aber ist es denn notwändig 2 Reaktionsgleichungen zu schreiben
( Die eine, wie aus Nb2O5 erstmal NbC wird und wie erst danach reines Nb entsteht)
Könnte man nich gleich eine Reaktionsgleichung daraus machen ?
Verfasst: 24.11. 2006 18:48
von alpha
Nein, wenn es nicht um reale Schritte geht, so brauchst du natürlich nicht zuerst das NbC zu formulieren...
Verfasst: 02.12. 2006 21:05
von Gast
Hey danke Leute
weiterhin wird aber in der Aufgabe gefordert die Reaktionsgleichungen zu bilden, wenn zu dem Niob(V)oxid bei mehr als 1000 °C noch Wasserstoff hinzugegeben wird und dabei Niob(|V)entsteht ( 1. )
und wenn zu dem entstandenem Niob(|V)oxid noch Magnesiumdampf hinzugegeben wird
und dabei elementares Niob entsteht ( 2. )
Also ich würd` sagen, dass das Nebenproduckt von 1. H2O und von 2. MgO ist.
Ist das so richtig oder gibt es hier wieder solch coole wärmeabhängige Gleichgewichte oder andere zu beachtende Regeln?
Bitte gebt mir eure Antworten
euer Gast

Verfasst: 03.12. 2006 10:23
von Gast
Sorry hab mich vertippt
bei 1. entsteht natürlich Niob(|V)oxid

Verfasst: 03.12. 2006 11:02
von ethoxyethan
rein hypothetisch, da mir ein 4wertiges Nb nicht bekannt ist:
Nb2O5 + H2 -> 2NbO2 + H2O
NbO2 + 2 Mg -> Nb + 2 MgO
Verfasst: 03.12. 2006 15:36
von Gast
da mir ein 4wertiges Nb nicht bekannt ist
steht aber so in der Aufgabe

Verfasst: 05.12. 2006 18:29
von Derselbe Gast wie oben
Danke Leute
Aber jetzt muss ich noch wissen, wie das dann ist, wenn das elementare Niob jetzt durch auswaschen mit Salzsäure von den anderen Reaktionsprodukten getrennt wird. Diese sind ja jetzt H2O und MgO. Aber ich find da irgendwie keinen Ansatz.
Nb + MgO + H2O + HCl -> Nb ? ( ich wird jetzt denken, dass Wasser und Magnesiumchlorid entsteht. Aber wenn da nun Wasser entsteht find ich keine Ausgleichmöglichkeit. Oder es entsteht ?Magnesiumdioxid?
 Bitte helft mir
Bitte helft mir
Verfasst: 05.12. 2006 19:22
von alpha
Weshalb ginge:
Nb + MgO + 2 HCl --> Nb + MgCl2 + H2O
nicht?
Grüsse
alpha
Verfasst: 05.12. 2006 20:58
von Gast
Achsooo,
jaaaa.... stimmt.....
Hab ich jetzt nicht dran gedacht....
tschuldigung, war in Gedanken noch beim Sauerstoff und hab das somit alles durcheinander gebracht.
Aber nun wolln die noch wissen, warum ein Gemisch aus Niob und Magnesiumoxid durch auswaschen mit Salzsäure getrennt werden kann.
Is das da richtig, wenn ich sage, dass sich durch die Salzsäure MgCl2 ausbildet und sich dieses Salz im Wasser löst, das Nb sich aber nicht löst, und somit das Nb herausgefiltert werden kann?