Seite 1 von 1
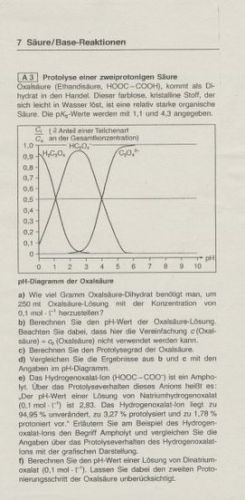
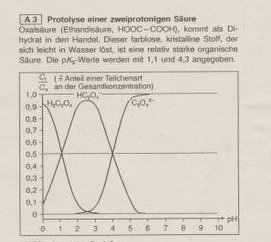
Protolyse einer zweiprotonigen Säure
Verfasst: 01.12. 2006 14:40
von Gast
Hallo Leute,
sitze gerade an den Aufgaben hier und hätte wirklich ein wenig Unterstützung nötig:(....es wäre sehr nett, wenn ihr mir helfen könntet!
Befürchte fast, dass man die Aufgaben auf dem Zettel nicht so richtig lesen kann...(kann man die Einleitung lesen, oder soll ich sie nochmal rein schreiben?)
also ich versuch mal die erste:
a) Wie viel Gramm Oxalsäure-Dihydrat benötigt man, um 250 mL Oxalsäure-Lösung mit der Konzentration von 0,1 mol/L herzustellen?
Ich habe mir dazu folgendes überlegt (allerdings stört mich hierbei das Dihydrat...und deshalb bin ich nicht ganz sicher, ob mein Weg so stimmen kann...)
und zwar sind ja Volumen und zu erreichende Konzentration gegeben...aus diesen beiden Größen kann ich ja die Stoffmenge berechnen..., macht: 0,025mol
Dann bestimmte ich mal die molare Masse= 126 g/mol
ergib mit meiner Stoffmenge zusammen, die gesuchte Masse von 3,15g...
ist das so richtig...oder kann ich das nicht so berechnen, weil ja Oxalsäure-Dihydrat sich um 2 H2O-Moleküle von der Oxalsäure unterscheidet?!
Ich warte mal auf ne Antwort und rechne so lange weiter;-)
Verfasst: 01.12. 2006 15:06
von ethoxyethan
Nein, das passt so.
ein mol hat ja 126g...
Verfasst: 01.12. 2006 15:29
von Gast
gut, danke:D (auch wenn ich die Begründung jetzt nicht verstanden habe;-) )
Dann zu b):
Berechnen Sie den pH-Wert der Oxalsäure-Lösung. Beachten Sie dabei, dass hier die Vereinfachung c(Ox.Säure)=c0(Ox.Säure) nicht verwendet werden kann.
Hier ist mein Problem, dass ich mir nicht sicher bin, wie ich vorgehen soll...
Entweder ich benutze die Formel für schwache Säure (denn immerhin handelt es sich um eine starke ORGANISCHE Säure (siehe Einleitungstext) ) ...oder ich mach das mit dem MWG und berechne erst einmal die Konzentration (nehme als nicht die 0,1 mol/L aus a) ) und berechne dann mit der Gleichung für schwache (oder doch starke?) Säuren den pH-Wert.
Also bei der ersten Möglichkeit (der einfacharen;-) ) hab ich raus: pH= 1,05
Verfasst: 01.12. 2006 15:38
von alpha
würde das mit dem MWG machen...
zu deiner ersten Frage: du brauchst ja die Stoffmenge an Oxalsäure; in 126 g Dihydrat sind 1 mol Oxalsäure, deshalb rechnest du mit dieser molaren Masse...
Verfasst: 01.12. 2006 16:11
von Gast
dann hab ich raus: 0,79...kann das stimmen?
das setze ich doch dann in die Formel für schwache Säuren ein, oder?
Verfasst: 01.12. 2006 17:14
von ethoxyethan
du hast ja zwei mol H+ pro mol oxalsäure(soweit verständlich?)
jedes dieser H+ hat einen anderen pKs wert...
um das zu vereinfachen nimmt man nur den stärkeren
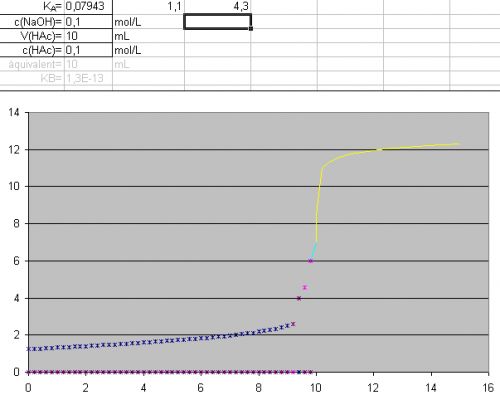
habe in eine selbst erstellte exceltabelle mal deine pKs werte eingesetzt:
blau: pKs1, rosa: pKs2
pH0=1,25(aus quadratischer gleichung)
wenn du die tabellen habe willst schreib mir eine nachricht...
Verfasst: 01.12. 2006 17:45
von Gast
so, nun habe ich als Konzentration raus 0,049 mol/L
und als pH-Wert= 1,2
Das müsste so auch in etwa stimmen;-)
nun soll ich als nächstes den Protolysegrad bestimmen...und den erhalte ich ja aus dem Bruch der Wurzel der Säurekonstante (10^4,3) und der Anfangskonzentration (0,1 mol/L)...ist das richtig?
Verfasst: 02.12. 2006 16:23
von Gast
hmm...vielleicht könnt ihr mir ja sagen, wie ihr den Protolysegrad ausrechnen würdet..bei mir haben irgendwie alle 57% raus:(
Verfasst: 02.12. 2006 16:37
von alpha
Hätte das jetzt so gemacht: 0.049 M Oxalsäure --> Protolysegrad = 100% --> [H+] = 2*0.049 M;
In der Lösung vorliegende Protonenkonzentration kannst du ja aus dem pH-Wert ausrechnen, wieviel Prozent das sind ist dann ein Dreisatz...
Grüsse
alpha
Verfasst: 03.12. 2006 11:00
von Gast
okay;-)
dann nur noch zwei Aufgaben:(
Aufgabe: Das Hydrogenoxalat-Ion (HOOC-COO-) ist ein Ampholyt. Über das Protolyseverhalten dieses Anions heißt es: "Der pH-Wert einer Lösung von Natriumhydrogenoxalat (0,1mol/L) ist 2,83. Das Hydrogenoxalat-Ion liegt zu 94,95% unverändert, zu 3,27% protolysiert und zu 1,78% protoniert vor".
Erläutern Sie am Beispiel des Hydrogenoxalat-Ions den Begriff des Ampholyt und vergleichen Sie die Angaben über das Protolyseverhalten des Hydrogenoxalat-Ions mit der graphischen Darstellung.
Gut...also was ein Ampholyt ist weiß ich: Eine Verbindung, die sowohl als Säure als auch als Base reagieren kann! und das Hydrogenoxalat-Ion kann sowohl ein Proton aufnehmen, als auch eins abgeben...ist also auch eins!
Diese ganzen Prozentangaben kann ich allerdings nicht am Graphen nachvollziehen...das der pH-Wert 2,83 ist erkennt man wohl daran, dass der Graph hier seinen Hochpunkt hat...joa wäre nett wenn ihr mir vielleicht erklären könntet wie ich an die Aufgabe ran gehen sollte!
dann eine weitere Aufgabe dazu: Berechnen Sie den pH-Wert einer Lösung von die Natriumoxalat ( 0,1 mol/L). Lassen Sie dabei den zweiten Protolyseschritt der Oxalsäure unberücksichtigt.
Dinatriumoxalat müsste doch eine Base sein, oder?! Immerhin haben wir statt zwei Wasseratomen, zwei Natriumionen....also müsste ich hier doch mit dem pKb-Wert rechnen...oder nicht?
Nehme ich dann die 4,3 (vom Einleitungstext) und ziehe ich von 14 ab?
Verfasst: 03.12. 2006 18:13
von Gast
Gut, ich weiß jetzt wie man den Protolysegrad bestimmt!
und zwar kommt für die protolysierten Ionen raus 0,057 mol/L (nicht 0,049 mol/L!)...
und protolisierte Ionen geteilt durch Ausgangskonzentration (0,1 mol/L) ergibt 57%

....JUHU:D
So...nun brauch ich nur noch die letzte Aufgabe zu lösen...
Könnt ihr mir wenigstens sagen, welche Werte ich benutzen muss?
Verfasst: 03.12. 2006 18:32
von ethoxyethan
Kb=Kw/Ka
pKa=-log(Ka)
Verfasst: 10.12. 2006 16:28
von Gast
Ich finde, es sehr nett, dass hier geholfen wird...aber wenn man etwas nicht weiß, dann sollte man lieber keine Verwirrung anstiften!
Hier nimmt man nämlich nur den pKB Wert..den berechnet man aus dem zweiten pKs Wert, da die erste Protolysestufe von Oxalsäure der korrespondierenden Säure entspricht...und schon kommt man aufs Ergebnis!
Verfasst: 10.12. 2006 17:46
von alpha
an wen war dieser Kommentar nun gerichtet? *aufdemSchlauchsteh*


