Probleme mit einigen pH-Wert-Berechnungen
Verfasst: 08.12. 2006 18:59
also es handelt sich um folgende aufgaben:
1.)a)berechnen sie den pH-wert einer 0.1 mol ammoniaklösung (hinweis:kb= 10 hoch -4.8 mol/l). welchen pH-wert hat die 0.1 N schwefelsäurelösung, die zur titration der ammoniaklösung eingesetzt wird?
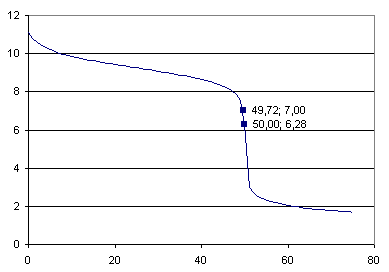
b) skizzieren sie für die o.g. titration schematisch den verlauf der titrationskurve, zeichen sie den neutralpunkt, den äquivalenzpunkt und den pufferbereich ein und erklären sie deren bedeutung.
2) welchen pH-wert hat die pufferlösung, die 0.1 mol ammoniak und 0.2 mol ammoniumchlorid in 1 ltr. gelöst enthält? (hinweisks-wert für ammonium= 9,21)
3) zur herstellung des kunstdüngers ammoniumnitrat soll ammoniak mit salpetersäure umgesetzt werden. wie viel liter 0.5 mol salpetersäure sind einzusetzen, wenn 100kg ammoniumnitrat hergestellt werden sollen, der umsatz der reaktion jedoch nur 90% beträgt?
danke schonmal
lg
1.)a)berechnen sie den pH-wert einer 0.1 mol ammoniaklösung (hinweis:kb= 10 hoch -4.8 mol/l). welchen pH-wert hat die 0.1 N schwefelsäurelösung, die zur titration der ammoniaklösung eingesetzt wird?
b) skizzieren sie für die o.g. titration schematisch den verlauf der titrationskurve, zeichen sie den neutralpunkt, den äquivalenzpunkt und den pufferbereich ein und erklären sie deren bedeutung.
2) welchen pH-wert hat die pufferlösung, die 0.1 mol ammoniak und 0.2 mol ammoniumchlorid in 1 ltr. gelöst enthält? (hinweisks-wert für ammonium= 9,21)
3) zur herstellung des kunstdüngers ammoniumnitrat soll ammoniak mit salpetersäure umgesetzt werden. wie viel liter 0.5 mol salpetersäure sind einzusetzen, wenn 100kg ammoniumnitrat hergestellt werden sollen, der umsatz der reaktion jedoch nur 90% beträgt?
danke schonmal
lg