Lewis Struktur von No3-
Verfasst: 30.01. 2011 17:08
Hallo Leute,
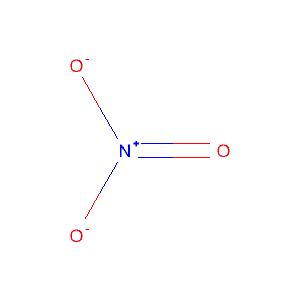
gehe grade ein paar alte Klausuren durch, und bin über die Struktur eines Moleküls gestolpert und zwar NO3-
Kann mir evtl einer erklären, wieso das Ding so gezeichnet wird (s.u.) und nicht mit zwei Doppelbindungen zu den O-Atomen, (die dann wiederrum jeweils noch zwei Elektronenpaare bekommen)? So das am Ende nur ein O-Atom eine negative Ladung hat.
Schonmal danke für die Hilfe!
mfg
gehe grade ein paar alte Klausuren durch, und bin über die Struktur eines Moleküls gestolpert und zwar NO3-
Kann mir evtl einer erklären, wieso das Ding so gezeichnet wird (s.u.) und nicht mit zwei Doppelbindungen zu den O-Atomen, (die dann wiederrum jeweils noch zwei Elektronenpaare bekommen)? So das am Ende nur ein O-Atom eine negative Ladung hat.

Schonmal danke für die Hilfe!
mfg