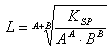ich hoffe, Ihr könnt mir helfen und erklärt mir, wie ich folgende Aufgabe der Reihe nach rechnen muss (ausführlich wäre nicht schlecht):
In einem Liter einer 0,02 m Salzsäure sind 0,01 mol Co 2+ gelöst. Es ist zu berechnen, ob Cobaltsulfid ausfällt, wenn die Lösung mit H2S gesättigt wird. Volumenänderungen können unberücksichtigt bleiben.
Löslichkeitsprodukt von CoS: 6*10-21 Konzentration H2S: 0,1 mol/l
K1 bzw. K2 für H2S: 10-7 bzw. 10-13
DANKE!!!