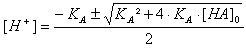Folgende Teilaufgabe in einer Aufgabe zum Thema "Haber-Bosch" ist gestellt:
e) Wie viel Gramm Ammoniak müssen in Wasser eingeleitet werden, damit daraus 500mL Lösung mit dem pH 11,5 entstehen?
Mein Vorschlag:
e) gesucht: 500mL Lösung mit pH = 11,5
pH = 11,5; c(OH-) = 10^-2,5 mol/L = 3,2 * 10^-3 mol/L;
n(OH-) in 500mL Lösung: 1,58 * 10^-3 mol/L
n(NH3) = n (OH-) = 1,58 * 10^-3 mol/L
m(NH3) = n(NH3) * M(NH3) = 1,58 10^-3 mol/L * 17,01 g/mol = 0,027g
Mir ist noch nicht ganz klar, ob man die Stoffmenge der Hydroxidionen einfach mit der Stoffmenge von NH3 gleichsetzen kann.
Mit der Nutzung dieses Forums (dies beinhaltet auch die Regisitrierung als Benutzer) erklärt Sie sich mit unserer Datenschutzerklärung (https://www.chemiestudent.de/impressum.php) einverstanden. Sofern Sie dieses nicht tun, dann greifen Sie bitte nicht auf unsere Seite zu. Als Forensoftware wird phpBB verwendet, welches unter der GNU general public license v2 (http://opensource.org/licenses/gpl-2.0.php) veröffentlicht wurde.
Das Verfassen eines Beitrag auf dieser Webseite erfordert keine Anmeldung und keine Angabe von persönlichen Daten. Sofern Sie sich registrieren, verweisen wir Sie auf den Abschnitt "Registrierung auf unserer Webseite" innerhalb unserer Datenschutzerklärung.
Das Verfassen eines Beitrag auf dieser Webseite erfordert keine Anmeldung und keine Angabe von persönlichen Daten. Sofern Sie sich registrieren, verweisen wir Sie auf den Abschnitt "Registrierung auf unserer Webseite" innerhalb unserer Datenschutzerklärung.
Frage: Ammoniak in Wasser einleiten pH-Wert Berechnung
Moderator: Chemiestudent.de Team
-
ethoxyethan
- Assi-Schreck

- Beiträge: 195
- Registriert: 25.10. 2006 20:52
- Wohnort: Wien
nein, darf man nicht...
du kannst dir die OH- conc. ausrechnen und dann die formel für schwache säure/base umformen.
[OH-]=3,161*10^-3 mol/L
[NH3]=0,566 mol/L
=>0,283 mol
=>4,81g
=>6,34L
du kannst dir die OH- conc. ausrechnen und dann die formel für schwache säure/base umformen.
[OH-]=3,161*10^-3 mol/L
[NH3]=0,566 mol/L
=>0,283 mol
=>4,81g
=>6,34L
Man ist erst dann so richtig betrunken, wenn man nicht mehr alleine, ohne fremde Hilfe, auf dem Rücken liegen kann.
-
Gast
Wie kommt man denn auf die [NH3]=0,566 mol/L? Formel für schwache Säure/Base?ethoxyethan hat geschrieben:nein, darf man nicht...
du kannst dir die OH- conc. ausrechnen und dann die formel für schwache säure/base umformen.
[OH-]=3,161*10^-3 mol/L
[NH3]=0,566 mol/L
=>0,283 mol
=>4,81g
=>6,34L
Heißt das, ich brauch nen pKs-Wert?
-
Manes_Schatz
- Grignardkühler

- Beiträge: 121
- Registriert: 07.02. 2006 19:42
- Hochschule: Bonn: Rheinische Friedrich-Wilhelms-Universität
- Wohnort: Bonn
- Kontaktdaten:
Die Formel, die er meint, lautet:
[formel]pOH=\frac{pK_B-lg c_0}{2}
[/formel]
Man macht mit dieser Formel zwar prinzipiell einen Fehler, aber bei Basen, die so schwach sind wie Ammoniak (oder schwächer), ist der Fehler vernachlässigbar klein.
pOH bekommst Du aus dem pH-Wert, pKB kannst du aus der Literatur erhalten und c0 ist das, was du suchst.
Damit kannst du dann ausrechnen, wieviel Ammoniak man einleiten muß.
[formel]pOH=\frac{pK_B-lg c_0}{2}
[/formel]
Man macht mit dieser Formel zwar prinzipiell einen Fehler, aber bei Basen, die so schwach sind wie Ammoniak (oder schwächer), ist der Fehler vernachlässigbar klein.
pOH bekommst Du aus dem pH-Wert, pKB kannst du aus der Literatur erhalten und c0 ist das, was du suchst.
Damit kannst du dann ausrechnen, wieviel Ammoniak man einleiten muß.
-
ethoxyethan
- Assi-Schreck

- Beiträge: 195
- Registriert: 25.10. 2006 20:52
- Wohnort: Wien
-
Manes_Schatz
- Grignardkühler

- Beiträge: 121
- Registriert: 07.02. 2006 19:42
- Hochschule: Bonn: Rheinische Friedrich-Wilhelms-Universität
- Wohnort: Bonn
- Kontaktdaten:
Ich sags nur ungerne:
Aber meine Formel geht aus deiner hervor, wenn man die Annahme macht, daß im Gleichgewicht die Konzentration des Ammoniak quasi gleich der Ausgangskonzentration des Ammoniaks ist. Man macht zwar einen Fehler, aber der ist sehr klein. Und um einen pH-Wert / eine Konzentration auszurechnen, reicht die Näherung allemal aus.

Aber meine Formel geht aus deiner hervor, wenn man die Annahme macht, daß im Gleichgewicht die Konzentration des Ammoniak quasi gleich der Ausgangskonzentration des Ammoniaks ist. Man macht zwar einen Fehler, aber der ist sehr klein. Und um einen pH-Wert / eine Konzentration auszurechnen, reicht die Näherung allemal aus.
Wer ist online?
Mitglieder in diesem Forum: Bing [Bot] und 2 Gäste