|
Reduktion
zurück zum Inhaltsverzeichnis
Nach einem Vortrag von Florian Stadler
Diese Reaktion dient zur Deoxygenierung von Alkoholen und besteht aus einem zweistufigen Prozeß.
Im ersten Schritt wird der Alkohol zu einem Thiocarbonylester, Xanthate bzw. Thiocarbonylimidazolid derivatisiert.
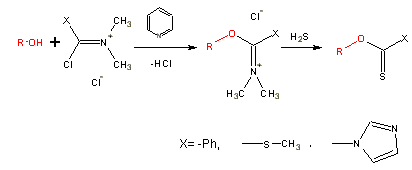
Den zweiten Schritt stellt die eigentliche Reduktion des Alkoholderivats mit Tributylzinnhydrid (Bu3SnH /TBTH (Zinn= tin eng.)) dar. Sie läuft nach einem Radikalkettenmechanismus ab.
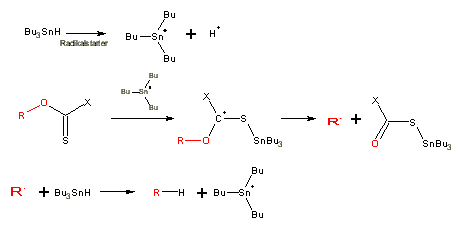
Vorteile der Reduktion mit Bu3SnH
- hohe Ausbeuten (70-90%)
- relativ schnell (1-4 Std.)
- leicht handhabbar
- milde Bedingungen (neutrales Milieu)
Nachteile
- relativ teuer
- sehr toxisch
- Sn-Reste schlecht vom Produkt abtrennbar
Als alternative Reduktionsmittel bieten sich Laurylperoxid [H3C(CH2)10COO]2 / 2-Propanol (Nachteil: schlechte Ausbeuten bei e--ziehenden Gruppen im Thiocarbonylradikal) oder Alkylsilane wie z.B. Et3SiH, Ph2SiH2,... (Nachteile: relativ teuer, relativ langsamer H-Transfer, keine Verwendung von aromatischen Lösemitteln möglich)[Lit. 6].
Eine weitere Variante bietet Polystyrol-organozinnhydrid [Lit. 7]. Neben guten Ausbeuten kann es auch leicht vom Produkt abfiltriert werden, jedoch ist es sehr teuer und benötigt die 2- bis 4-fache Reaktionszeit des Bu3SnH.
Literatur
[1] D.H.R. Barton;S.W. McCombie: A new method for the deoxygenation of secundary alkohols;.J. Chem. Soc. Perkin Trans I;1975;1574ff
[2] D.H.R. Barton, W.B. Motherwell; New and selective reactions and reagents in carbohydrate chemistry; Pure & Appl. Chem.; 1981;15ff
[3] D.H.R. Barton, W.B. Motherwell, A. Stange; Radical-induced deoxygenationi of primary alcohols; Synthesis; 1981; 743f
[4] D.H.R. Barton, W. Hartwig, Robyn S.H. Motherwell, W.B. Motherwell, A. Stange; Radical deoxygenation of tertiary alcohols; Tetrahedon Lett.; 1982; 2019ff
[5] Beatrice Quiclet-Sire; A practical modification of the Barton-McCombie reaction; Tetrahydron Lett.; 1998; 9435ff
[6] S.J. Cole, N. Kirwal; Radical chain reduction of alkyl halides, dialkyl sulfides and o-AIkyl-S-methyl dithiocarbonates to alkanes by trialkysilanes; J. Chem. Soc. Perkin Trans I;1991; 103ff
[7] W.P Neumann, M Petersheim; Elegant improvement of the deoxygenation of alcohols using a polystyrene supported organotin hydride; Synlett; 1992; 801f
Nach einem Vortrag von Christiane Kofink
Meistens werden Carbonylverbindungen durch Aluminiumverbindungen reduziert, da jene sehr starke Hydridüberträger darstellen. Des weiteren bieten sie den Vorteil, dass sie zumeist keine C-C Doppel- oder Dreifachbindungen angreifen. Der Nachteil ist, dass sie rasch mit protischen Lösungsmitteln unter Freisetzung von molekularem Wasserstoff reagieren. Deshalb verwendet man aprotische Solventien, meist DEE (Diethylether) oder THF (Tetrahydrofuran), wobei die anschließende Hydrolyse der Aluminiumalkoxyde zum Produkt führt.
Die Reaktivität der Hydride wird kontrolliert durch:
- Eigenschaften des Metall-Ions
- Liganden neben dem Hydrid. Beispiel: LiAlH4 > NaAlH4; Grund: größere Lewis-Säurestärke; Härte des Lithiumions
- Substanzen, welche die Metall Ionen komplexieren - sie verlangsamen die Reduktion. Grund: Kation wird gehindert die Carbonylgruppe zu aktivieren.
Die Darstellung von Aluminiumhydriden erfolgt dadurch, dass ein oder mehrere Hydridliganden gegen eine Alkoxidgruppe ausgetauscht werden.
LiAlH4 + 2 ROH --> LiAlH2(OR)2 + 2 H2
LiAlH4 + 3 ROH --> LiAlH2(OR)3 + 3 H2
Der Vorteil ist die bessere Löslichkeit bei niedrigeren Temperaturen und die höhere Selektivität.
Übersicht:
| | LiAlH4 | LiAlH(OMe)3 | LiAlH(OtBu)3 | DIBAL | RED-Al |
| R-CHO --> Alkohol | + | + | + | + | |
| R-COR' --> Alkohol | + | + | + | + | |
| R-COX --> Alkohol | + | + | + | - | |
| Epoxid --> Alkohol | + | (-) | (-) | + | + |
| Ester --> Alkohol | + | + | - | Ald. | |
| R-CO2H --> Alkohol | + | + | (-) | | |
| Amid --> Amin | + | + | - | Ald. | |
| RCN --> Alk.,Amin | + | + | - | Ald.+Amin | |
DIBAL: (iBu)2AlH
Es werden meist stöchiometrische Mengen DIBAL bei tiefen Temperaturen zugesetzt. Es können so selektiv Aldehyde hergestellt werden, da die Reaktion in unpolaren Lösungsmitteln auf der Stufe des Tetraeder-Intermediats stehen bleibt, welches durch wässrige Aufarbeitung in das Aldehyd überführt werden kann.
Zum Beispiel: vom Ester zum Aldehyd und vom Nitril zum Aldehyd
Reaktionsbedingungen: -60°C, Toluol
RED-Al: NaAlH2(OCH2CH2OCH3)2
Regioselektive Reduktion von Epoxyalkoholen zu enantiomerenreinen 1,3-Diolen.
LiAlH(OR)3: R=tBu,Et3C,Et,Me
Die Reaktivität hängt von der entsprechenden Alkylgruppe ab. Da nur ein Hydrid übertragen werden kann, wird jeweils nur das reaktivste Zentrum des zu reduzierenden Stoffes angegriffen, was eine sehr hohe Selektivität zur Folge hat.
Allgemein gilt: LiAlH4 > LiAlH(OMe)3 > LiAlH(OtBu)3 (>...reaktiver als)
Literatur:
R. Brückner;Reaktionsmechanismen;Spektrum;1996
S.D. Burke;Handbook of Reagents for org. Synthesis; Wiley 1999
F. Carey; Org. Chemie;VCH;1995
Nach einem Vortrag von Sabine Otto
Übersicht:
| NaBH4 | Natriumborhydrid | | LiBHEt3 | Superhydrid | | NaBH3CN | Natriumcyanotrihydroborat | | LiHB(CH(CH3)CH2CH3)3 | L-Selecride | | LiHB(CH(CH3)CH(CH3)2)3 | LS-Selecride | | NaHB(CH(CH3)CH2CH3)3 | N-Selecride | | KHB(CH(CH3)CH2CH3)3 | N-Selecride |
Relative Reaktivität von Hydrid-Donoren bei Reduktionen:
| | Iminium-Ion | Aldehyd | Keton | Ester | Amidy | | NaBH4 | Amin | Alkohol | Alkohol | Alkohol | - | | NaBH3CN | Amin | Alkohol | - | - | - | | L-Selecride | | Alkohol | Alkohol | - | aldehyd | | LiBHEt3 | | Alkohol | Alkohol | Alkohol | |
Literatur:
R. Brückner;Reaktionsmechanismen;Spektrum Verlag;1996
S.D. Burke;Handbook of Reagents for org. Synthesis;Wiley;1999
C.F. Lane;Synthesis;135;1975
Nach einem Vortrag von Gunter Heymann
Generell kann man sagen, dass die Leichtigkeit der Reduktion von organischen Halogeniden nach der Reihe I>Br>Cl>>F abnimmt und somit parallel zur Dissoziationsenergie der Kohlenstoff-Halogenbindung verläuft (CH3-I 234 kJ/mol;CH3-Br 293 kJ/mol;CH3-Cl 351 kJ/mol;CH3-F 452 kJ/mol;). Was die Reaktivität der Halogene angeht, so werden prim. Halogene bevorzugt nach dem SN2 Mechanismus reduziert und tert.>sec.>prim nach dem SN1 und Radikalkettenmechanismus.
Ein Li- oder Na-Alkohol-System ist geeignet zur Reduktion von Brückenköpfen, ungesättigte C=C-Bindungen bleiben unbeeinträchtigt
Die Reduktion von Alkylfluoriden gestaltet sich wegen der starken C-F Bindung als schwer. Dennoch besitzt zum Beispiel ein System aus Kalium gelöst in Kronen-ethern ("nackte" Ionen) eine ausreichend hohe Reduktionseigenschaft und somit werden prim., sec. und tert. Alkylfluoride bei Raumtemperatur reduziert.
Tributylzinn-Hydride
Iodide und Bromide reagieren in einer spontanen Reaktion mit Radikalinitiator (UV/AIBN) auch ohne Lösungsmittel. Bei Chloriden braucht man einen Radikalinitiator und erhöhte Temperatur. Fluoride sind praktisch unreaktiv.
Mit Bu3SnH ist die stufenweise Reduktion von Alkylhalogeniden möglich, auch werden Brückenkopfhalogene reduziert. Eine hohe Chemoselektivität sorgt dafür, dass Alkohole, Alkane, Alkine, Ketone, Nitrile, Nitro-Gruppen, Ester, Epoxide und sogar Peroxide nicht angegriffen werden.
Organosilan-Hydride
Sind im allgemeinen inert gegenüber Alkylhalogeniden. Ein sehr effektives Reduktionsreagenz (vergleichbar mit Bu3SnH) ist das tris-(Trimethylsilyl)-Silan (Me3Si)SiH; hier ist die Dissoziationsenergie der Si-H-Bindung um 11 kcal/mol niedriger als beim Et3SiH. Aus ökologischen und toxikologischen Gründen sind Organosilan-Hydride dem Bu3SnH vorzuziehen. Lithiumaluminiumhydrid
Die Vorteile sind hohe Ausbeuten, konventioneller Umgang und leicht zu entfernende Nebenprodukte. Chloride reagieren nach dem SN2 Mechanismus,Bromide nad SN2 und Radikalkettenmechanismus (SET),Iodide hauptsächlich nach SET.
Literatur:
Tsuneo Imamoto;Comprehensive Organic Chemistry;1992;793ff
S. Krishnamurthy,H.C. Brown;J.Org.Chem.;1982;47;276-280
M. Ballestri,C. Chatgilialoglu;J.Org.Chem.;1991;56;678-683
C. Chatgilialogiu,D. Griller;J.Org.Chem.;1988;53;3641f
M.P. Doyle,C.C. McOsker,C.T. West;J.Org.Chem.;1976;441;1393-95
T. Ohsawa;Tetrahedron Letters;1981;22;2583-2586
Nach einem Vortrag von F.F. Doris Weber
Es werden den eigentlichen Reduktionsmitteln BH3 . THF, BH3 . Me2S bzw. Catecholboran optisch aktive Katalysatoren zugesetzt, um die optische Information zu übertragen. Drei Beispiele für diese Katalysatoren werden im folgenden angeführt.
Oxazaborolidine (CBS-Reduktion: Corey Bakshi,Shibata)
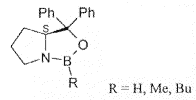
Enone und sterisch leicht gehinderte Ketone wie Aryl-Aryl-Ketone werden mit hoher Stereoselektivität reduziert. Reaktivere Ketone (sterisch weniger gehindert) reagieren auch ohne Katalysator aber bei geringerer Stereoselektivität. Gar nicht geeignet sind alpha-Oxo-Ester.
B-3-pinanyl-9-borabicyclo[3.3.1]nonan (Alpin-Boran)
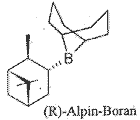
Es können alpha-Oxo-Ester, Cyano-Ketone sowie Alkynyl-Ketone mit hoher Stereoselektivität reduziert werden. Letztere können vielseitig weiterreagieren. Praktische Anwendung: Synthese von Steroiden und deuterierten optisch aktiven Alkoholen zur Aufklärung von Reaktionsmechanismen und biochemischen Reaktionen. Nicht geeignet zur Reduktion von aliphatischen und aromatischen Ketonen.
Chlorodiisopinocampheylboran (Ipc2BCl)
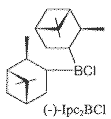 Geeignet für Aryl-Alkyl-Ketone,alpha-tert.-Alkyl-Ketone und alpha-halogenierte Ketone. Nicht geeignet für Allylketone, Enone und alpha-Oxo-Ester.
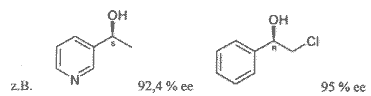
Literatur:
Eliel, Wilen;Stereochemistry of organic compounds;1994;S 214-274
Synthesis;1992;S 605-612
zurück zum Inhaltsverzeichnis
|